Где применяется число авогадро. Важнейшее положение в химии Закон авогадро и его следствия химия кратко
Физическая величина, равная количеству структурных элементов (которыми являются молекулы, атомы и т.п.) на один моль вещества, называется числом Авогадро. Официально принятое на сегодняшний день его значение составляет NA = 6,02214084(18)×1023 моль−1, оно было утверждено в 2010 году. В 2011 были опубликованы результаты новых исследований, они считаются более точными, но на данный момент официально не утверждены.
Закон Авогадро имеет огромное значение в развитии химии, он позволил вычислять вес тел, которые могут менять состояние, становясь газообразными или парообразными. Именно на основе закона Авогадро начала свое развитие атомно-молекулярная теория, следующая из кинетической теории газов.
Более того, с помощью закона Авогадро разработан способ получения молекулярной массы растворенных веществ. Для этого законы идеальных газов были распространены и на разбавленные растворы, взяв за основу мысль, что растворенное вещество распределится по объему растворителя, как газ распределяется в сосуде. Также закон Авогадро дал возможность определить истинные атомные массы целого ряда химических элементов.
Практическое использование числа Авогадро
Константа используется при расчетах химических формул и в процессе составления уравнений химических реакций. С помощью нее определяют относительные молекулярные массы газов и число молекул в одном моле любого вещества.
Через число Авогадро вычисляется универсальная газовая постоянная, она получается путем умножения этой константы на постоянную Больцмана. Кроме того, умножив число Авогадро и элементарный электрический заряд, можно получить постоянную Фарадея.
Использование следствий закона Авогадро
Первое следствие закона гласит: «Один моль газа (любого) при равных условиях будет занимать один объем». Таким образом, в нормальных условиях объем одного моля любого газа равен 22,4 литра (эта величина называется молярным объемом газа), а используя уравнение Менделеева-Клапейрона можно определить объем газа при любом давлении и температуре.
Второе следствие закона: «Молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму». Иными словами, при одинаковых условиях, зная отношение плотности двух газов, можно определить их молярные массы.
Во времена Авогадро его гипотеза была недоказуема теоретически, однако позволяла легко устанавливать экспериментальным путем состав молекул газа и определять их массу. Со временем под его эксперименты была подведена теоретическая база, и теперь число Авогадро находит применение
Принцип, который в 1811 году сформулировал итальянский химик Амадео Авогадро (1776-1856), гласит: при одинаковых температурах и давлении в равных объемах газов будет содержаться одинаковое число молекул, независимо от их химической природы и физических свойств. Это число является физической константой, численно равной количеству молекул, атомов, электронов ионов или других частиц, содержащихся в одном моле. Позднее гипотеза Авогадро, подтвержденная большим числом экспериментов, стала считаться для одним из основных законов, вошедшим в науку под названием закон Авогадро, и его следствия все основаны на утверждении, что моль любого газа, в случае одинаковых условий, будет занимать одинаковый объем, называемый молярным.
Сам предполагал, что физическая константа является очень большой величиной, но только множество независимых методов, уже после смерти ученого, позволили экспериментально установить число атомов, содержащееся в 12 г (является атомной единицей массы углерода) или в молярном объеме газа (при Т = 273,15 К и р =101,32 кПа), равном 22,41 л. Константу принято обозначать, как NA или реже L. Она названа в честь ученого — число Авогадро, и равняется оно, примерно, 6,022 . 1023. Это и есть число молекул любого газа, находящегося в объеме 22,41 л, оно одинаково и для легких газов (водорода), и для тяжелых газов Закон Авогадро математически можно выразить: V / n = VM, где:
- V — объем газа;
- n — количество вещества, которое является отношением массы вещества к его массе молярной;
- VM — константа пропорциональности или молярный объем.
Амадео Авогадро принадлежал к благородному семейству, проживавшему в северной части Италии. Он родился 09.08.1776 в Турине. Его отец — Филиппо Авогадро — был служащим судебного ведомства. Фамилия на венецианском средневековом диалекте означала адвоката или чиновника, который взаимодействовал с людьми. По существовавшей в те времена традиции, должности и профессии передавались по наследству. Поэтому в 20 лет Амадео Авогадро получил степень, став доктором законоведения (церковного). Физику и математику он начал самостоятельно изучать в 25 лет. В своей научной деятельности занимался изучением и исследованиями в области электрохимии. Однако в историю науки Авогадро вошел, сделав к атомистической теории очень важное дополнение: ввел понятие о мельчайшей частице вещества (молекуле), способной существовать самостоятельно. Это было важно для объяснения простых объемных отношений между газами, вступившими в реакцию, а закон Авогадро стал иметь большое значение для развития науки и широко применяться на практике.
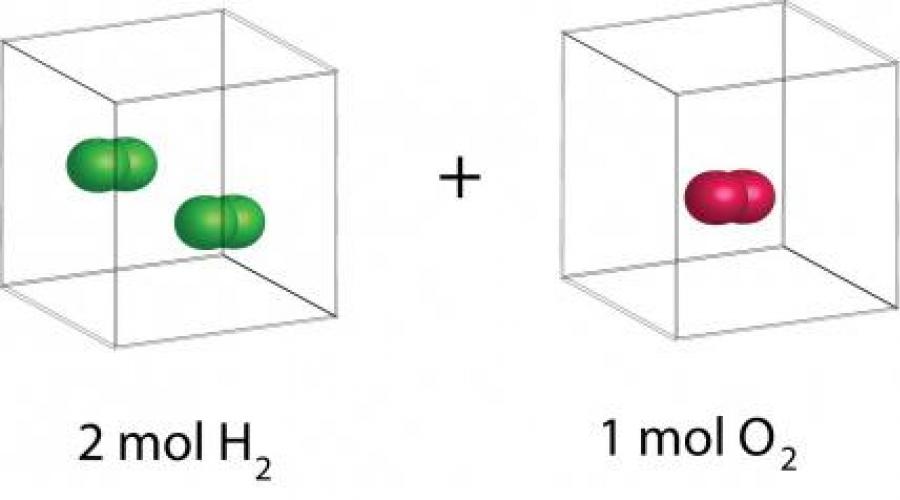
Но произошло это не сразу. Некоторыми химиками закон Авогадро был признан через десятилетия. Оппонентами итальянского профессора физики били такие знаменитые и признанные научные авторитеты, как Берцелиус, Дальтон, Дэви. Их заблуждения привели к многолетним спорам о химической формуле молекулы воды, так как существовало мнение, что ее следует записывать не H2O, а HO или H2O2. И только закон Авогадро помог установить состав и других простых и сложных веществ. Амадео Авогадро утверждал, что молекулы простых элементов состоят из двух атомов: O2, H2, Cl2, N2. Из чего следовало, что реакцию между водородом и хлором, в результате которой будет образован хлороводород, можно записать в виде: Cl2 + H2 → 2HCl. При взаимодействии одной молекулы Cl2 с одной молекулой H2, образуются две молекулы HCl. Объем, который будет занимать HCl, должен быть в два раза больше объема каждого, из вступивших в эту реакцию, компонентов, то есть должен равняться их суммарному объему. Только начиная с 1860 года, начал активно применяться закон Авогадро, и следствия из него позволили установить истинные значения атомных масс некоторых химических элементов.
Одним из основных выводов, сделанных на его основании, стало уравнение, описывающее состояние идеального газа: p .VM = R . T, где:
- VM — молярный объем;
- p — давление газа;
- T — абсолютная температура, К;
- R — универсальная газовая постоянная.
Объединенный также является следствием закона Авогадро. При постоянной массе вещества выглядит, как (p . V) / T = n . R = const, а его форма записи: (p1 . V1) / T1 = (p2 . V2) / T2 позволяет делать расчеты при переходе газа из одного состояния (обозначено индексом 1) в другое (с индексом 2).
Закон Авогадро позволил сделать и второй немаловажный вывод, открывший путь для экспериментального определения тех веществ, которые при переходе в газообразное состояние не разлагаются. M1 = M2 . D1, где:
- M1 — масса молярная для первого газа;
- M2 — масса молярная для второго газа;
- D1 — относительная плотность первого газа, которую устанавливают по водороду или воздуху (по водороду: D1 = M1 / 2, по воздуху D1 = M1 / 29, где 2 и 29 — это молярные массы водорода и воздуха соответственно).
Предвидеть результаты исследования, предугадать закономерность, почувствовать общие истоки - всем этим отмечено творчество большого числа экспериментаторов и учёных. Чаще всего прогноз распространяется лишь на область занятости исследователя. И мало у кого хватает смелости заняться долгосрочным прогнозированием, существенно опередив время. У итальянца Амедео Авогадро смелости было хоть отбавляй. Именно по этой причине данный учёный известен сейчас во всём мире. А закон Авогадро и по сей день используется всеми химиками и физиками планеты. В этой статье мы подробно расскажем о нём и его авторе.
Детство и учёба
Амедео Авогадро родился в Турине в 1776 году. Его отец Филиппе работал служащим в судебном ведомстве. Всего в семье было восемь детей. Все предки Амедео служили адвокатами при католической церкви. Молодой человек также не отступил от традиции и занялся юриспруденцией. К двадцати годам он уже имел степень доктора.
Со временем юридическая практика перестала увлекать Амедео. Интересы молодого человека лежали в другой сфере. Ещё в юности он посещал школу экспериментальной физики и геометрии. Тогда в будущем учёном и проснулась любовь к наукам. Из-за пробелов в знаниях Авогадро занялся самообразованием. В 25 лет Амедео всё свободное время уделял изучению математики и физики.
Научная деятельность
На первом этапе научная деятельность Амедео была посвящена изучению электрических явлений. Интерес Авогадро особо усилился после того как Вольт открыл источник электрического тока в 1800 году. Не менее интересны молодому учёному были дискуссии Вольта и Гальвани о природе электричества. Да и в целом тогда данная область была передовой в науке.
В 1803 и 1804 годах Авогадро вместе с братом Феличе представил учёным из Туринской Академии две работы, раскрывающие теории электрохимических и электрических явлений. В 1804 году Амедео стал членом-корреспондентом данной академии.
В 1806 году Авогадро устроился репетитором в Туринский лицей. А спустя три года учёный перебрался в лицей Верчелли, где преподавал математику и физику на протяжении десяти лет. В тот период Амедео прочитал много научной литературы, делая из книг полезные выписки. Он вёл их до конца жизни. Накопилось целых 75 томов по 700 страниц каждый. Содержание этих книг говорит о разносторонности интересов учёного и о том колоссальном труде, который он проделал.

Личная жизнь
Семейную жизнь Амедео устроил довольно поздно, когда его возраст уже перевалил за третий десяток. Работая в Верчелли, он встретил Анну ди Джузеппе, которая была намного моложе учёного. В этом браке родилось восемь детей. Никто из них не пошёл по стопам отца.
Закон Авогадро и его следствия
В 1808 году Гей-Люссак (в соавторстве с Гумбольдтом) сформулировал принцип объёмных отношений. Этот закон гласил, что соотношение между объёмами реагирующих газов можно выразить простыми числами. Например, 1 объём хлора, соединяясь с 1 объёмом водорода, даёт 2 объёма хлороводорода и т.п. Но данный закон ничего не давал, так как, во-первых, не было конкретного различия между понятиями корпускула, молекула, атом, а во-вторых, у учёных были разные мнения насчёт состава частиц различных газов.
В 1811 году Амедео занялся тщательным анализом результатов исследований Гей-Люссака. В итоге Авогадро понял, что закон объёмных отношений позволяет понять устройство молекулы газов. Гипотеза, которую он сформулировал, гласила: «Число молекул любого газа в одном и том же объёме всегда одинаково».

Открытие закона
Целых три года учёный продолжал экспериментировать. И в итоге появился закон Авогадро, который звучит так: «Равные объёмы газообразных веществ при одинаковой температуре и давлении содержат одинаковое количество молекул. А меру массы молекул можно определить по плотности различных газов». Например, если 1 литр кислорода содержит столько же молекул, сколько и 1 литр водорода, то отношение плотностей данных газов равно отношению массы молекул. Также учёный отметил, что молекулы в газах не всегда состоят из одиночных атомов. Допустимо наличие как разных, так и одинаковых атомов.
К сожалению, во времена Авогадро данный закон нельзя было доказать теоретически. Но он давал возможность устанавливать в экспериментах состав молекул газов и определять их массу. Давайте проследим логику подобных рассуждений. В ходе эксперимента было выявлено, что пары воды из газа, а также объёмы водорода и кислорода соотносятся в пропорции 2:1:2. Из этого факта можно сделать разные выводы. Первый: молекула воды состоит из трёх атомов, а молекулы водорода и кислорода из двух. Вполне уместен и второй вывод: молекулы воды и кислорода двухатомны, а водорода - одноатомны.

Противники гипотезы
У закона Авогадро было много противников. Отчасти это было связано с тем, что в те времена отсутствовала простая и ясная запись уравнений и формул химических реакций. Главным недоброжелателем был Йенс Берцелиус - шведский химик, имеющий непререкаемый авторитет. Он считал, что у всех атомов есть электрические заряды, а сами молекулы состоят из атомов с противоположными зарядами, которые притягиваются друг к другу. Так, у атомов водорода был положительный заряд, а у атомов кислорода - отрицательный. С этой точки зрения молекулы кислорода, состоящей из 2-х одинаково заряженных атомов, просто не существует. Но если молекулы кислорода всё же одноатомны, то в реакции азота с кислородом пропорция соотношения объёмов должна быть 1:1:1. Данное утверждение противоречит эксперименту, где из 1 литра кислорода и 1 литра азота получали 2 литра оксида азота. Именно по этой причине Берцелиус и другие химики отвергали закон Авогадро. Ведь он абсолютно не соответствовал экспериментальным данным.

Возрождение закона
До шестидесятых годов девятнадцатого столетия в химии наблюдался произвол. Причём он распространялся как на оценку молекулярных масс, так и на описание химических реакций. Об атомном составе сложных веществ было вообще много неверных представлений. Некоторые учёные даже планировали отказаться от молекулярной теории. И только в 1858 году химик из Италии по имени Канниццаро нашёл в переписке Бертолле и Ампера ссылку на закон Авогадро и следствия из него. Это упорядочило запутанную картину химии того времени. Два года спустя Канниццаро рассказал о законе Авогадро в Карлсруэ на Международном конгрессе по химии. Его доклад произвёл на учёных неизгладимое впечатление. Один из них сказал, что он как будто прозрел, все сомнения испарились, а взамен появилось чувство уверенности.
После того как закон Авогадро признали, учёные могли не только определять состав молекул газов, но и рассчитывать атомные и молекулярные массы. Эти знания помогали в расчёте массовых соотношений реагентов в различных химических реакциях. И это было очень удобно. Измеряя массу в граммах, исследователи могли оперировать молекулами.

Заключение
Много времени прошло с тех пор, как был открыт закон Авогадро, но об основоположнике молекулярной теории никто не забыл. Логика учёного была безупречной, что позже подтвердили расчёты Дж. Максвелла, основанные на кинетической теории газов, а затем и экспериментальные исследования (броуновское движение). Также было определено, сколько содержится частиц в моле каждого газа. Эта константа - 6,022.1023 была названа числом Авогадро, увековечив имя проницательного Амедео.
Закон Авогадро, открытый в 1811 г., сыграл большую роль в развитии хими. Прежде всего он способствовал признанию атомно-молекулярного учения, сформулированного впервые в середине XVIII в. М.В. Ломоносовым. Так, например, пользуясь числом Авогадро:
оказалось возможным вычислять не только абсолютные массы атомов и молекул, но и собственно линейные размеры этих частиц. Согласно закону Авогадро:
«В равных объёмах различных газов при постоянном давлении и температуре содержится одинаковое число молекул, равное »
Из закона Авогадро вытекает ряд важных следствий касающихся молярного объёма и плотности газов. Так, из закона Авогадро непосредственно следует, что одинаковое число молекул различных газов будут занимать одинаковый объём, равный 22,4 литра. Такой объём газов получил название молярного объёма . Верно и обратное – молярный объём различных газов одинаков и равен 22,4 л:
![]()
Действительно, поскольку 1 моль любого вещества содержит одинаковое число молекул, равное , то очевидно и их объёмы в газообразном состоянии при одинаковых условиях будут одинаковыми. Таким образом, при нормальных условиях (н.у.), т.е. при давлении ![]() и температуре молярный объём различных газов будет составлять
и температуре молярный объём различных газов будет составлять ![]() . Количество вещества , объём и молярный объём газов могут быть связаны между собой в общем случае соотношением вида:
. Количество вещества , объём и молярный объём газов могут быть связаны между собой в общем случае соотношением вида:
откуда соответственно:
В общем случае различают нормальные условия (н.у.):
![]()
к стандартным условиям относят:
![]()
Для того чтобы перевести температуру по шкале Цельсия в температуру по шкале Кельвина, используют следующее соотношение:
![]()
Массу собственно газа можно вычислить по значению его плотности , т.е.
Поскольку как было показано выше:


тогда очевидно:
откуда соответственно:
![]()
Из приведенных нами выше соотношений вида:
после подстановки в выражение:
также следует, что:
![]()
откуда соответственно:
и таким образом имеем:
Поскольку при нормальных условиях 1 моль любого занимает объём равный:
![]()
тогда соответственно:
Полученное таким образом соотношение достаточно важно для понимания 2-го следствия из закона Авогадро, которое в свою очередь непосредственно связано с таким понятием как относительная плотность газов . В общем случае, относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее или легче другого, т.е. во сколько раз плотность одного газа больше или меньше плотности другого, т.е. имеем соотношение вида:
Так, для первого газа имеем:
соответственно для второго газа:
тогда очевидно:

и таким образом:
Другими словами, относительная плотность газа есть отношение молекулярной массы исследуемого газа к молекулярной массе газа, с которым производится сравнение. Относительная плотность газа – безразмерная величина. Таким образом, для того чтобы вычислить относительную плотность одного газа по другому, достаточно знать молекулярные относительные молекулярные массы этих газов. Для того чтобы было понятно, с каким газом проводят сравнение, ставят индекс. Например, обозначает, что сравнение проводят с водороду и тогда говорят о плотности газа по водороду, не употребляя уже слово «относительная», принимая это как бы по умолчанию. Аналогично измерения проводят, беря в качестве газа сравнения – воздух. В этом случае указывают, что сравнение исследуемого газа проводят с воздухом . При этом средняя молекулярная масса воздуха принимается равной 29 , а поскольку относительная молекулярная масса и молярная масса численно совпадают, тогда:
![]()
Химическая формула исследуемого газа ставится рядом в скобках, например:
и читается как – плотность хлора по водороду. Зная относительную плотность одного газа по отношению к другому, можно вычислить молекулярную, а также молярную массу газа, даже если формула вещества неизвестна. Все приведенные выше соотношения относятся к так называемым нормальным условиям.
История
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку . Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были объяснены в 1811 году итальянским физиком Амедео Авогадро .
Следствия закона
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём .
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л . Этот объём называют молярным объёмом газа V m . Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона :
.Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму .
Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d - удельный вес его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар без разложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного веса воздуха , принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу удельный вес водорода . Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С , мы из формулы имеем с другой стороны m = dC . Так как удельный вес пара определяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела.
Элементарный анализ, например, одного из полибутиленов указывает, в нём пайное отношение углерода к водороду, как 1 к 2, а потому частичный вес его может быть выражен формулой СН 2 или C 2 H 4 , C 4 H 8 и вообще (СН 2) n . Частичный вес этого углеводорода тотчас определяется, следуя закону Авогадро, раз мы знаем удельный вес, т. е. плотность его пара; он определен Бутлеровым и оказался 5,85 (по отношению к воздуху); т. е. частичный вес его будет 5,85 · 28,9 = 169,06. Формуле C 11 H 22 отвечает частичный вес 154, формуле C 12 H 24 - 168, а C 13 H 26 - 182. Формула C 12 H 24 близко отвечает наблюденной величине, а потому она и должна выражать собою величину частицы нашего углеводорода CH 2 .
Примечания
Ссылки
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). - СПб. , 1890-1907.
Wikimedia Foundation . 2010 .
Смотреть что такое "Закон Авогадро" в других словарях:
ЗАКОН АВОГАДРО - равные объёмы любых идеальных газов при одинаковых условиях (температуре, давлении) содержат одинаковое число частиц (молекул, атомов). Эквивалентная формулировка: при одинаковых давлении и температуре одинаковые количества вещества различных… … Большая политехническая энциклопедия
закон Авогадро - – закон, согласно которому в равных объемах идеальных газов при одинаковых температуре и давлении содержится одинаковое число молекул. Словарь по аналитической химии … Химические термины
закон Авогадро - Avogadro dėsnis statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas(ai) Grafinis formatas atitikmenys: angl. Avogadro’s hypothesis; Avogadro’s law; Avogadro’s principle vok. Avogadrosche Regel, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
закон Авогадро - Avogadro dėsnis statusas T sritis fizika atitikmenys: angl. Avogadro’s hypothesis; Avogadro’s law vok. Avogadrosche Regel, f; Avogadrosches Gesetz, n; Satz des Avogadro, m rus. закон Авогадро, m pranc. hypothèse d’Avogadro, f; loi d’Avogadro, f … Fizikos terminų žodynas
закон Авогадро - Avogadro dėsnis statusas T sritis Energetika apibrėžtis Apibrėžtį žr. priede. priedas(ai) MS Word formatas atitikmenys: angl. Avogadro’s law vok. Avogadrosches Gesetz, n rus. закон Авогадро, m pranc. loi d’Avogadro, f … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
См. Химия и Газы. З. вечности вещества, или сохранения массы материи, см. Вещество, Лавуазье, Химия. З. Генри Дальтона см. Растворы. З. Гибса Ле Шателье см. Обратимость химических реакций. З. (теплоемкостей) Дюлонга и Пти см. Теплота и Химия. З.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Необходимое, существенное, устойчивое, повторяющееся отношение между явлениями. 3. выражает связь между предметами, составными элементами данного предмета, между свойствами вещей, а также между свойствами внутри вещи. Существуют 3.… … Философская энциклопедия
АВОГАДРО ЗАКОН - (Avogadro), основан на высказанной в 1811 г. итальянским физиком Авогадро гипотезе, гласящей, что «при одинаковых условиях t° и давления, в равных объемах всех газов содержится одно и то же число молекул». Из этой гипотезы.,… … Большая медицинская энциклопедия
- (Avogadro) Амедео, граф ди Кваренья (1776 1856), итальянский физик и химик. В 1811 г. выдвинул гипотезу (ныне известную как закон Авогадро) о том, что равные объемы газов при одном давлении и одинаковой температуре содержат одинаковое число… … Научно-технический энциклопедический словарь
- (Avogadro) Амедео (1776 1856), итальянский физик и химик. Основатель молекулярной теории строения вещества (1811). Установил один из газовых законов (1811; закон Авогадро), согласно которому в равных объемах идеальных газов при одинаковых… … Современная энциклопедия