Планы уроков молекулярная физика спо. Молекулярная физика (разработка урока)
Барковская Светлана Евгеньевна
Учебное заведение:
МОУ сш № рп Кузоватово Ульяновской области
Краткое описание работы:
Нестандартные задачи требуют нестандартного мышления, их решение невозможно свести к алгоритму. Поэтому наряду с традиционными методами необходимо вооружить учащихся и эвристическими методами решения задач, которые основаны на фантазии, преувеличении, «вживании» в изучаемый предмет или явление и др.
Сачук Татьяна Ивановна
Учебное заведение:
Краткое описание работы:
Представленное поурочное планирование по физике предназначено для учащихся 11 класса, обучающихся на профильном уровне, составлено в соответствии с программой для общеобразовательных учреждений, рекомендованной на федеральном уровне: Примерная программа среднего (полного) общего образования.
Сачук Татьяна Ивановна
Учебное заведение:
ГБОУ СОШ №1 "ОЦ" им. Героя Советского Союза С.В. Вавилова с. Борское
Краткое описание работы:
Представленное поурочное планирование по физике предназначено для учащихся 10 класса, обучающихся на базовом уровне, составлено в соответствии с программой для общеобразовательных учреждений, рекомендованной на федеральном уровне: Примерная программа среднего (полного) общего образования.
Физика — это раздел естествознание, который изучает наиболее общие законы природы и материи. В российский школах физика преподается в 7-11 классах На нашем сайте материалы по физике находятся в разделах: Конспекты уроков Технологические карты Контрольные и проверочные Лабораторные и практические Самостоятельные Тесты Подготовка к ЕГЭ Подготовка к ОГЭ Олимпиадные задания Викторины и игры Внеклассные мероприятия […]
Поурочные планы по физике на портале Конспектека
Планирование учебного процесса является неотъемлемой частью работы любого учителя. Грамотно составленный поурочный план представляет собой залог успешного усвоения учебного материала учащимися. Важность и трудоемкость процесса составления поурочных планов по физике вынуждает многих педагогов искать готовые разработки в интернете. Раздел «Поурочное планирование» для учителей физики на сайте Конспектека содержит работы, присланные нашими читателями - учителями с многолетним стажем. Материалы предназначены для облегчения учительского труда - их вы можете скачать в ознакомительных целях и использовать в качестве источника вдохновения и новых идей. Разработки соответствуют принципам, закрепленных во ФГОС, и отражают новейшие тенденции в образовании.
База нашего сайта постоянно пополняется новыми разработками, поэтому если у вас имеется готовый поурочный план либо какой-либо иной материал, мы будем рады опубликовать его на страницах нашего сайта.
Цель урока: Формировать умение описывать тепловые явления с помощью статического метода, основанного на молекулярно – кинетических представлениях о строении вещества, убедить учащихся в реальности микромира, возможности его познания, рассмотреть экспериментальные доказательства существования и движения молекул.
Ход урока
- Анализ контрольной работы.
- Изучение нового материала.
Историческая справка
Ещё в 5 веке до новой эры древнегреческий ученый Демокрит утверждал: «Ничто не существует, кроме атомов и пустого пространства. Всё прочее есть мнение… Атомы бесконечны в числе и бесконечно различны по форме».
В 4 веке появилось учение Аристотеля, которое позднее будет поддержано христианской церковью: «Любое тело может делиться до бесконечности».
В 1646 году француз Пьер Гассенди высказал предположение, что атомы объединяются в небольшие группы «молекулы» (от лат. «moles» – масса)
В 18 веке М. В. Ломоносов предположил, что молекула может быть однородной и разнородной и находиться в в хаотичном состоянии. В этом же веке Бернулли применил понятие о молекуле для объяснения давления газов.
В 1827 году английский ботаник Броун обнаружил движение спор плауна (болотного растения), взвешенных в воде.
В 1905 году А. Эйнштейн объяснил броуновское движение некомпенсированными ударами молекул жидкости о частицу.
В 1908 году французский физик Ж. Перрен экспериментально подтвердил теорию броуновского движения.
Формирование основных понятий статистической физики.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – это явления, связанные с нагреванием или охлаждением тел.
Тепловое движение молекул – это беспорядочное и хаотическое движение молекул.
- Формирование основных положений МКТ и их опытное обоснование
| Основные положения | Экспериментальное обоснование |
| 1. Все вещества состоят из частиц. | Возможность механического дробления веществ, растворение вещества в воде, диффузия, сжатие и расширение газов. |
2.  Частицы хаотично движутся. Частицы хаотично движутся.
|
Диффузия – явление проникновения молекул одного вещества между молекулами другого вещества. Броуновское движение мелких, взвешенных в жидкости частиц под действием ударов молекул |
| 3. Частицы взаимодействуют друг с другом: одновременно проявляя силы взаимного притяжения и отталкивания. | Для разрыва твердого тела необходимо некоторое усилие, в то же время твердые и жидкие тела трудно сжимаемы.
Капли жидкости, помещенные в непосредственной близости друг от друга, сливаются. |
Фронтальный эксперимент .
Наблюдение броуновского движения в жидкости с помощью микроскопа. Препарат готовим из раствора акварельной краски в воде. Каплю этой смеси помещают на предметное стекло и наблюдают за поведением взвешенных в воде частиц.
Обсуждение вопроса о размерах молекул.
Знакомство с опытом Р. Влея, который помещал каплю оливкового масла на поверхность воды, налитой в большой сосуд. Влей предположил, что, когда капля перестанет растекаться, её толщина станет равной диаметру одной молекулы.
Дано: СИ: V = Sd; d= V/S S
![]() V = 1 мм² 1·10̄̄-9 м3
V = 1 мм² 1·10̄̄-9 м3
S = 0.6м² d= 1·10-9/0,6 = 1,7·10-9(м) SSS
Оценка числа молекул, содержащихся в капле воды массой 1 г.
Дано: СИ: Объем V₀, занимаемый молекулой воды при плотной упаковке, равен
Конспект открытого урока по теме «Постоянный электрический ток» I курс (СПО)
Цель урока: Обобщение знаний по теме "Постоянный электрический ток".
Задачи:
образовательная: повторить основные величины, понятия, законы.
развивающая: устанавливать логические связи между физическими величинами, понятиями, уметь обобщать полученные знания.
воспитательная: уметь работать в группах, получать положительную мотивацию от полученных знаний.
Оборудование:
Интерактивная доска
Лабораторное оборудование:
амперметр,
вольтметр,
2 резистора,
выключатель,
соединитель провода.
Наглядность : электрическая цепь, путеводитель.
Ход урока
Организационный момент.
Вступительное слово учителя. Сегодня ребята нам предстоит обобщить изученный материал по теме "Постоянный электрический ток", совершив путешествие по стране "Электричество". И начнем с города "Перепутье".
Основная часть урока.
1) "Перепутье". Время - 5 мин.
Найди правильную дорогу. На интерактивной доске представлены все изученные физические величины. Найти правильную дорогу, последовательно провести линии.
Задание распечатано на листах и раздается всем учащимся и 1 учащийся у доски.
2) "Подумайград". Время - 2 мин.
Вопрос записан на доске. Устно. Кто первый ответит? (Используется Презентация РРS).
Вопрос: Почему количество единиц измерения не соответствует количеству физических величин?
Ответ: 1) А (работа), Q (количество теплоты) - имеют одну и ту же единицу измерения [Дж] Джоуль.
2) Е (электродвижущая сила), U (напряжение) - также имеют одну и ту же единицу измерения [В] - Вольт.
3) "Формулград". От каждой группы выходят к доске по 1 ученику. Время - 5 мин.
Допиши формулу. 3 человека выполняют на доске, остальные учащиеся выполняют в рабочих тетрадях.
4) "Прибороград". На интерактивной доске представлена следующая таблица. Учащиеся на листах с подписанными фамилиями отвечают цифрами (1-5), (2-6) и т.д. Время 3 мин.
Вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Молекулярная физика - раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения.
Тепловое движение - беспорядочное (хаотическое) движение атомов или молекул вещества.
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Молекулярно-кинетическая теория - теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения.
Основные положения молекулярно-кинетической теории:
- вещество состоит из частиц - молекул и атомов, разделенных промежутками,
- эти частицы хаотически движутся,
- частицы взаимодействуют друг с другом.
МАССА И РАЗМЕРЫ МОЛЕКУЛ
Массы молекул и атомов очень малы. Например, масса одной молекулы водорода равна примерно 3,34*10 -27 кг, кислорода - 5,32*10 -26 кг. Масса одного атома углерода m 0C =1,995*10 -26 кг
Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:(атомная единица массы).
Количество вещества - это отношение числа молекул N в данном теле к числу атомов в 0,012 кг углерода N A:
Моль - количество вещества, содержащего столько молекул, сколько содержится атомов в 0,012 кг углерода.
Число молекул или атомов в 1 моле вещества называют постоянной Авогадро:
Молярная масса - масса 1 моля вещества:
Молярная и относительная молекулярная массы вещества связаны соотношением: М = М r *10 -3 кг/моль.
СКОРОСТЬ ДВИЖЕНИЯ МОЛЕКУЛ
Несмотря на беспорядочный характер движения молекул, их распределение по скоростям носит характер определенной закономерности, которая называется распределением Максвелла.
График, характеризующий это распределение, называют кривой распределения Максвелла. Она показывает, что в системе молекул при данной температуре есть очень быстрые и очень медленные, но большая часть молекул движется с определенной скоростью, которая называется наиболее вероятной. При повышении температуры эта наиболее вероятная скорость увеличивается.
ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Идеальный газ - это упрощенная модель газа, в которой:
- молекулы газа считаются материальными точками,
- молекулы не взаимодействуют между собой,
- молекулы, соударяясь с преградами, испытывают упругие взаимодействия.
Иными словами, движение отдельных молекул идеального газа подчиняется законам механики. Реальные газы ведут себя подобно идеальным при достаточно больших разрежениях, когда расстояния между молекулами во много раз больше их размеров.
Основное уравнение молекулярно-кинетической теории можно записать в виде
Скорость называют средней квадратичной скоростью.
ТЕМПЕРАТУРА
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении.
Термометр - прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре ее кипения - 100°С.
Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин).
Связь температуры в энергетических единицах и температуры в градусах Кельвина:
где k = 1,38*10 -23 Дж/К - постоянная Больцмана.
Связь абсолютной шкалы и шкалы Цельсия:
T = t + 273
где t - температура в градусах Цельсия.
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:
Средняя квадратичная скорость молекул
Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так:
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Пусть газ массой m занимает объем V при температуре Т и давлении р , а М - молярная масса газа. По определению, концентрация молекул газа: n = N/V , где N -число молекул.
Подставим это выражение в основное уравнение молекулярно-кинетической теории:
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ).
1. Изотермический процесс
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Если Т =const, то
Закон Бойля-Мариотта
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p 1 V 1 =p 2 V 2 при Т = const
График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
Если газ, имея объем V 0 находится при нормальных условиях: а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
Обозначив
получим V=V 0 T
Коэффициент называют температурным коэффициентом объемного расширения газов. График процесса, происходящего при постоянном давлении, называется изобарой .
3. Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
Закон Шарля
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
Если газ, имея объем V 0 ,находится при нормальных условиях:
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р , то можно записать
График процесса, происходящего при постоянном объеме, называется изохорой .
Пример. Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12°С, если масса этого воздуха 2 кг?
Из уравнения состояния идеального газа
определим величину давления.
План-конспект урока
по физике
на тему «Уравнение Менделеева-Клапейрона. Газовые законы»
Разработал: Гончарова С. Д.
преподаватель физики ГБПОУ ЛО
«Волховский колледж транспортного строительства»
Волхов
2016
Тема урока: «Уравнение Менделеева-Клапейрона. Газовые законы»
Дата проведения : 1 0 .11.2016
Тип урока: комбинированный
Технология урока: групповая технология.
Цель урока : 1. Проведение контроля выполнения домашнего задания, оценка уровня полученных ранее знаний и умений.
2. Вывод связи между тремя макроскопическими параметрами идеального газа – уравнение Менделеева-Клапейрона, изучение частных случаев перехода газа из одного состояния в другое (изопроцессы), когда неизменной величиной является один из макроскопических параметров.
3. Развитие научного представлениястудентов о происходящих процессах в газах, физической речи, учебной активности и самостоятельности обучающихся; логического мышления; умения выделять главное, анализировать, обобщать, делать выводы, развитие адекватной оценки и самооценки.
4. Воспитание дисциплинированности, аккуратности, ответственного отношения к учебному труду; формирование умения принимать решения, работать в коллективе.
Планируемые образовательные результаты.
Владение физическими понятиями: давление газа, основное уравнение МКТ идеального газа, параметры состояния газа, термодинамическая шкала температур, основное уравнение состояния газа, уравнение Клапейрона, уравнение Менделеева, универсальная газовая постоянная, изопроцесс, изотермический процесс, изохорный процесс, изобарный процесс, изотерма, изохора, изобара.
Знание единиц измерения параметров газа, закономерностей изменения параметров состояния газа при изопроцессах,
Владение газовыми законами: Бойля-Мариотта, Шарля, Гей-Люссака;
Умение обнаруживать зависимость между давлением газа и его микропараметрами, между давлением, его объемом и температурой;
Сформированность умения решать физические задачи с использованием основного уравнения МКТ, уравнения Менделеева-Клапейрона, газовых законов, читать и строить графики изопроцессов;
Сформированность умения применять газовые законы для объяснения физических явлений в природе и для принятия практических решений в повседневной жизни:
Владение методами описания, анализа полученной информации и обобщения.
Основные термины, понятия: основное уравнение состояния газа, уравнение Менделееа-Клапейрона, универсальная газовая постоянная, изопроцесс, изотермический процесс, изохорный процесс, изобарный процесс, изотерма, изохора, изобара.
Оборудование: индивидуальные листы, тесты, компьютер, мультимедийное оборудование, презентация PowerPoint .
План урока
1. Мотивация.
2. Проверка домашнего задания.
3. Актуализация знаний.
4. Изучение нового материала.
5. Закрепление полученных знаний.
6. Обобщение нового материала и первичный контроль полученных знаний.
7. Домашнее задание.
8. Рефлексия.
Занятия в колледже проводятся «парами», т.е. продолжительность занятия составляет 90 мин. Данная тема рассчитана на 90 минут.
Предварительно были изучены взаимоотношения в группе, предпочтения общения обучающихся и уровень подготовки по дисциплине «Физика». Эта работа проведена была с целью формирования малых групп для работы на уроке. Сделана схема рассадки. Группы формируются по 4-5 человек, сидящих за соседними партами в одном ряду. Такой способ группировки позволяет форму работы (в парах, индивидуальная) без временных затрат.
Формы контроля и оценки результатов урока: устный опрос, тестовые задания, письменные задания (решение задач, заполнение таблицы).
Ход урока
Этапы урокаДеятельность учителя
Деятельность учащихся
Планируемые образовательные результаты
Организационный момент
Приветствие обучающихся, отметка отсутствующих в журнале, положительный настрой на работу.
Сообщает, что изучают раздел «Основы молекулярной физики и термодинамики», тема «Основы молекулярно-кинетической теории. Идеальный газ».
Приветствие, подготовка учебных принадлежностей, настрой на урок.
Позитивный настрой на урок.
Этап контроля полученных ранее знаний (выполнение д/з)
- На прошлом занятии вы изучили тему «Основное уравнение МКТ идеального газа. Термодинамическая шкала температур».
Проверим, как вы справились с д.з.
Выдача заданий по вариантам:
1. Тест (Приложение 1);
2. Слайд с ключами к заданиям;
3. Анализ ошибок.
1. Выполнение теста, решение заданий.
2. Работа в парах.
Взаимопроверка. Оценка. Внесение оценки в индивидуальную карту.
3. Анализ ошибок, допущенных в ходе выполнения задания.
Воспитание ответственного отношения к учебному труду; Владение физическими понятиями: основное уравнение МКТ идеального газа, параметры состояния газа, термодинамическая шкала температур; Умение обнаруживать зависимость между давлением газа и его микропараметрами;
Развитие активности, ответственности, самостоятельности, логического мышления.
Этап формулирования темы урока, постановки целей (2 мин.)
Преподаватель:
- На предыдущем занятии вы выяснили, какая существует связь между давлением газа и его микропараметрами. Эта связь выражена основным уравнением молекулярно-кинетической теории идеального газа. Из известных формул мы выведем связь между тремя макроскопическими параметрами, запишем её в двух видах: в форме, полученной Клапейроном, и форме, полученной Менделеевым;
Установим связь между тремя макроскопическими параметрами газа в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных. Итак, тема сегодняшнего урока: «Уравнение Менделеева- Клапейрона. Газовые законы».
(Слайд с темой урока, целью и задачами)
Записывают тему урока в тетрадь.
Умение ставить перед собой цели и задачи.
Этап актуализации знаний
Фронтальный опрос, за правильный ответ в индивидуальной карте преподаватель ручкой особого цвета выставляет «+».
Вспомним основные понятия и величины, с которыми мы будем сегодня работать:
1) Что в МКТ называется идеальным газом?
2)Какие параметры газа называются микроскопическими?
3) Назовите макропараметры состояния газа, их обозначения и ед. изм. в СИ.
4) Как связана средняя кинетическая энергия поступательного движения молекул с термодинамической температурой (формула)?
5) Как связана средняя кинетическая энергия поступательного движения молекул со средней квадратичной скоростью движения?
6) Что такое концентрация молекул? Как обозначают эту величину?
7) Что называют количеством вещества? Как обозначается эта величина и в каких единицах измеряется?
8) Какое число молекул (атомов) содержится в 1 моле вещества? Как называется это число?
9) Что называют молярной массой?
10) Запишите основное уравнение МКТ идеального газа. Назовите величины, входящие в формульное выражение.
Отвечают с места по поднятой руке или по назначению преподавателя.
1) Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.
2) Масса молекулы (атома) m o ,
средняя квадратичная скорость молекул - v , концентрация молекул – n .
3) Давление, объем и температура.
Р – давление, ед. изм. в СИ – Па.
V - объём, ед. изм. в СИ - м 3 .
Т – температура, ед.изм. в СИ – К.
4) , где Е к – средняя кинетическая энергия поступательного движения частиц;
Т - термодинамическая температура;
k – постоянная Больцмана.
5)  , где
, где
m 0 – масса молекулы;
v - средняя квадратичная скорость молекул.
6) Концентрация – отношение числа молекул к объёму. 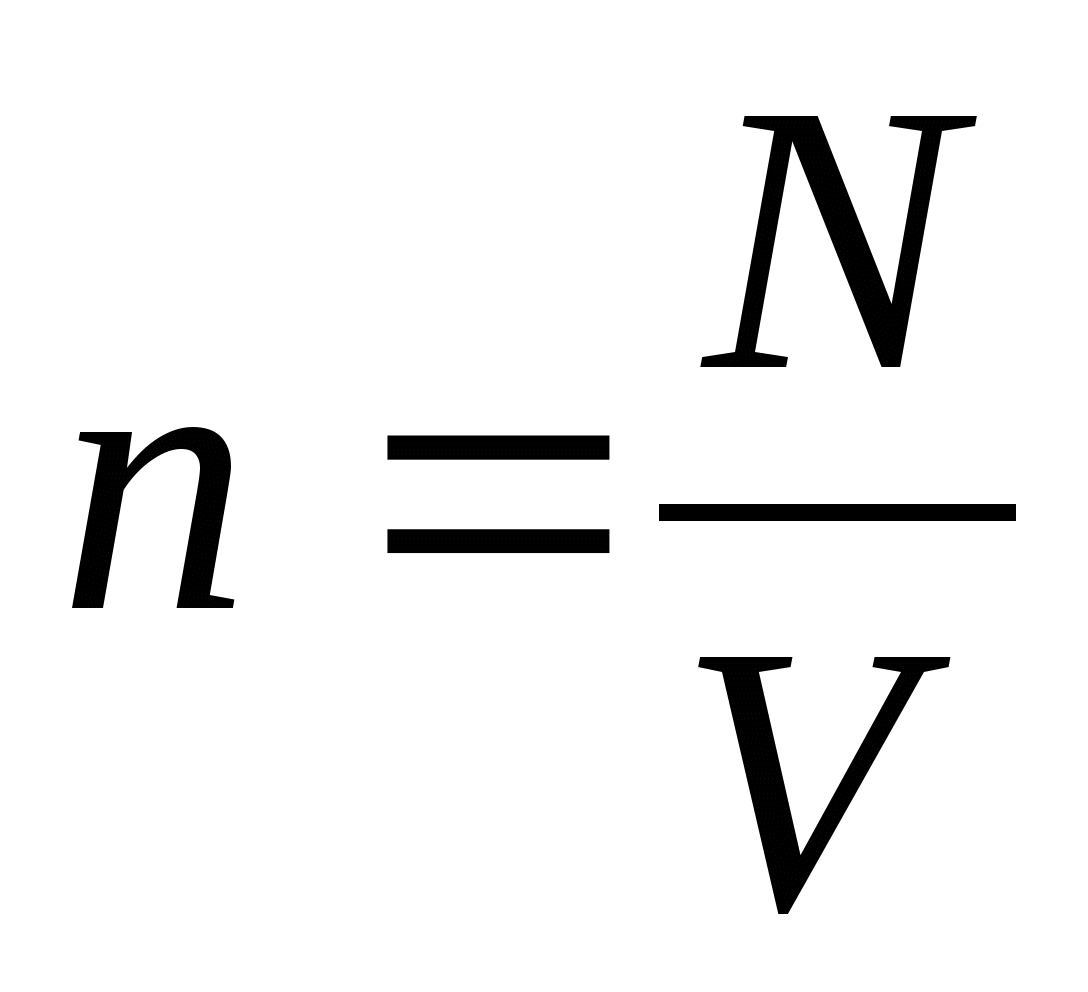 , где
, где
n – концентрация;
N - число молекул;
V - объём.
7) Количество вещества – это отношение числа молекул в данном макроскопическом теле к числу атомов, содержащихся в 12 г углерода (N
A
):  .
.
Ед. изм. - моль.
8) В 1 моле содержится N A = 6,02 ·10 23 моль -1 .
N A – число Авогадро.
9) Молярная масса – масса 1 моля вещества.
10)  .
.
p – давление газа.
n – концентрация.
m 0 - масса молекулы (атома).
v – средняя квадратичная скорость движения молекул (атомов).
Умения выделять главное;
Знание единиц измерения параметров газа, закономерностей изменения параметров состояния газа.
Развитие физической речи.
Этап изучения нового материала
(25 мин.)
На этом этапе работа организуется в группах. Преподаватель объясняет критерии оценивания работы на данном этапе.
Как известно, основное уравнение МКТ идеального газа устанавливает зависимость давления от микропараметров. Но есть уравнение, которое связывает все три макроскопических параметра газа (давление, объём, температуру). Сейчас мы попытаемся это уравнение вывести.
1. Используя уравнение  ;
;  и получите формулу зависимости
p
от
T
.
и получите формулу зависимости
p
от
T
.
2.Учитывая, что 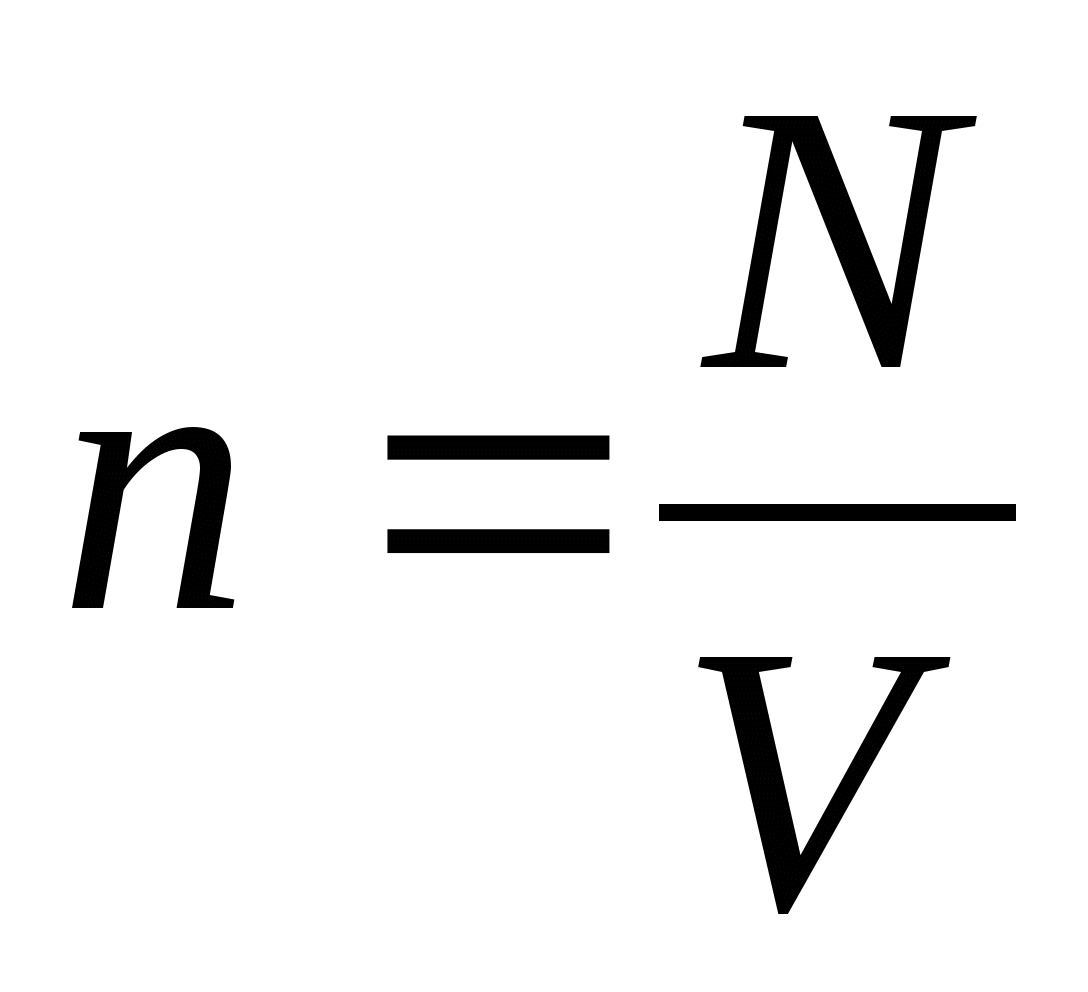 , запишите новое уравнение.
, запишите новое уравнение.
3. Преобразуйте уравнение таким образом, чтобы все макроскопические параметры оказались в левой части уравнения.
4. Рассмотрим полученное уравнение.
Впервые это уравнение вывел в 1834 г. французский учёный Бэнуа Клапейрон. Взяв только тот случай, когда масса порции газа постоянна, а, следовательно, и количество частиц постоянно, он сделал вывод: т.к.  , то
, то  - уравнение Клапейрона.
- уравнение Клапейрона.
5. В 1874 г. русский химик Дмитрий Иванович Менделеев несколько обобщил это уравнение. Данное уравнение он рассмотрел для 1 моля вещества:
 моль, т.е. N
= N
A
.
моль, т.е. N
= N
A
.
Запишите новый вид уравнения.
6.Как вы заметили, в правой части стоит произведение двух постоянных величин, соответственно, результатом будет тоже постоянная величина. Эту постоянную назвали универсальной газовой постоянной и обозначили R .

 - уравнение Менделеева.
- уравнение Менделеева.
 , получаем:
, получаем:
 или
или
 .
.
8. Учитывая, что 

9.Рассмотрим частные случаи – процессы в газах, когда неизменной величиной является один из макропараметров. Такие процессы называют изопроцессами («изос» - равный). Изопроцессы в газах бывают изотермическими, изохорными и изобарными.
10. Начнем с изотермического процесса. Изотермическим процессом называется процесс в газах, протекающий при неизменном количестве вещества и постоянной температуре: v =const , T =const .
Сегодня мы рассматривали уравнение  . Для изотермического процесса следует вывод
. Для изотермического процесса следует вывод  - закон Бойля-Мариотта.
- закон Бойля-Мариотта.
Или 
Из данного равенства можно составить пропорцию  . Откуда видно, что при изотермическом процессе давление газа обратно пропорционально его объёму.
. Откуда видно, что при изотермическом процессе давление газа обратно пропорционально его объёму.
Что является графиком обратной пропорциональности?
Графиком является ветка гиперболы – изотерма.

11. Изохорным (изохорическим) процессом называется процесс в газах, протекающий при неизменном количестве вещества и постоянном объеме: v =const , V =const .
Из  для изохорного процесса =>
для изохорного процесса =>  - закон Шарля.
- закон Шарля.
 Откуда можно получить
Откуда можно получить  , т.е. давление газа прямо пропорционально температуре.
, т.е. давление газа прямо пропорционально температуре.
Графиком является изохора:

Следует обратить внимание на то, что на графике присутствует область, близкая к абсолютному нулю температур, в которой данный закон не выполняется. Поэтому прямую в области, близкой к нулю, следует изображать пунктирной линией.
12. Изобарным (изобарическим) процессом называется процесс в газах, протекающий при неизменном количестве вещества и постоянном давлении: v =const , p =const .
Из  для изобарного процесса =>
для изобарного процесса =>  - закон Гей-Люссака.
- закон Гей-Люссака.
 Откуда можно получить
Откуда можно получить  , т.е. объём газа прямо пропорционален температуре.
, т.е. объём газа прямо пропорционален температуре.
Графиком является изобара.
Работа в группах: в группах выбираются обучающиеся, которые следят за работой группы и оценивают работу каждого с выставлением отметки в индивидуальную карту.
Записывают в тетради вывод формул, сверяют полученные результаты с готовыми на слайдах.
1.
 .
.
Т.к. , то
 .
.
Т.е.  .
.
2.  .
.
3. Умножим обе части уравнения на V и разделим на T , получаем:

4. Записывают:
 - уравнение Клапейрона.
- уравнение Клапейрона.
5.
 моль, т.е.
N
=
N
A
.
моль, т.е.
N
=
N
A
.

6. - универсальная газовая постоянная;
- универсальная газовая постоянная;
 моль
-1
* ·1,38·10
-23
моль
-1
* ·1,38·10
-23  .
.
 - уравнение Менделеева.
- уравнение Менделеева.
7. В случае произвольного количества вещества  , получаем:
, получаем:

или
 .
.
8.Учитывая, что  , где µ - молярная масса, получаем
, где µ - молярная масса, получаем  - уравнение Менделеева-Клапейрона.
- уравнение Менделеева-Клапейрона.
9. Изопроцессы – процессы, протекающие в газах при постоянном количестве вещества и одном неизменном макропараметре.
10. Изотермический процесс: v =const , T =const .
Т.к. , v
=const
, T
=const
=>
, v
=const
, T
=const
=>  - закон Бойля-Мариотта.
- закон Бойля-Мариотта.
Или 
Т.е.  - (p
~ 1/V
).
- (p
~ 1/V
).
Гипербола.

Графиком является изотерма .
11. Изохорный (изохорический) процесс: v =const , V =const .
Из  =>
=>  - закон Шарля.
- закон Шарля.
Или  =>
=>  , (p
~ T
).
, (p
~ T
).
График - изохора :

12. Изобарный (изобарический) процесс: v =const , p =const .
Из  =>
=>  - закон Гей-Люссака.
- закон Гей-Люссака.
Т.е. =>
=>  . ( V ~ T).
. ( V ~ T).
График – изобара .
Владение физическими понятиями: параметры состояния газа, уравнение Менделеева-Клапейрона, универсальная газовая постоянная, изопроцесс, изотермический процесс, изохорный процесс, изобарный процесс, изотерма, изохора, изобара.
Знание единиц измерения параметров газа, закономерностей изменения параметров состояния газа при изопроцессах.
Умение обнаруживать зависимость между давлением газа, его объемом и температурой.
Умение логически мыслить; выделять главное, делать выводы.
Развитие физической речи.
Умение принимать решения, работать в коллективе.
Этап закрепления полученных знаний. Решение задач
(14 мин.)
Работа в группах. Группы зарабатывают дополнительные балы, если предлагают обоснованные шаги при решении поставленной задачи.
- Сейчас мы с вами выполним задания, пользуясь новыми знаниями.
1. Какое давление имеет 1 кг азота в объёме 1 м 3 при температуре 27 о С?
Запишите, что дано и что найти.
Какое уравнение устанавливает связь между макропараметрами газа?
2. Даны графики процессов в различных системах координат

Найти во всех трех системах координат:
Изотермы;
3.При температуре 27 о С давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13 о С?
Уравнение Менделеева-Клапейрона.
V = 1 м 3
t =27 o C
m =1 кг
µ(N 2)=28г/моль
R =8,31Дж/моль·К
Т=300 K
28∙10 -3 кг/моль
p – ?


Вычисления:

t 1 =27 o C
p 1 =75 кПа
t 2 =-13 o C
300 o K
75∙10 3 Па
263 o C
p 2 – ?
По закону Шарля: р/Т=const .
р 1 /Т 1 = р 2 /Т 2 ,
р 1 Т 2 =р 2 Т 1 ,
р 2 =р 1 Т 2 /Т 1 ,
р 2 =75∙10 3 ∙263/300=65кПа.
Ответ: 65кПа.
Умение решать физические задачи с использованием уравнения Менделеева-Клапейрона, газовых законов, читать и строить графики изопроцессов.
Развитие самостоятельности, аккуратности, вниматнльности.
Обобщение темы урока и первичный контроль знаний
1. Давайте подведем итог сегодняшнего урока. Что нового узнали на уроке?
(Фронтальный опрос).
2. Заполните таблицу:
На слайде таблица.
3. Выполните тестовые задания.
(Выдача тестовых заданий).
4. Ключ к тесту и критерии оценивания.
Какие вопросы остались непонятными для вас?
1. Пользуясь конспектом, учебником отвечают на вопросы.
2. Заполняют таблицу:

3. Выполнение теста. Индивидуальная работа.
4. Работа в парах Взаимопроверка и выставление отметки.
Если есть вопросы, то задают. Ответы могут давать обучающиеся, которым данные вопросы ясны или преподаватель.
Умение выделять главное, обобщать и анализировать.
Развитие физической речи.
Формирование ответственного отношения к оценке и самооценке; объективности оценки.
Оценочный этап. (2 мин.)
Выставление оценок за урок.
Обратитесь к вашим индивидуальным картам. В течение всего занятия там появлялись отметки. Выведите среднее арифметическое за весь урок. Назовите свои отметки.
Каждый обучающийся по 3-4 отметкам (устные ответы, тест по д/з, работа на уроке, тест в конце урока) как среднее арифметическое определяют оценку за урок, ответственные в группах контролируют правильность и объективность выставления отметок.
Формирование ответственного отношения к оценке и самооценке; объективности оценки.
Домашнее задание
Следующий урок – л.р. «Проверка закона Бойля-Мариотта».
1. Подготовить ответы на контрольные вопросы к л.р. (вопросы на стенде в кабинете и на сайте колледжа).
2. §§4.10-4.12, ответить на вопросы 20-25 на с. 123, выучить определения изопроессов, знать вывод уравнения М-К, уметь читать и строить графики изопроцессов.
3. Разобрать пример решения задачи №2, с. 123,
решить задачи №№ 3-5, с.125.
4*. По желанию: Подготовить сообщение об истории открытия газовых законов.
Записывают домашнее задание.
Формирование ответственного отношения к учебному труду, внимательности, аккуратности.
Этап рефлексии
Дорогие, друзья! Наш урок подошел к концу. Оставьте ваши отзывы об уроке.
Всем спасибо за урок! Желаю Вам успехов на других занятиях.
Обучающиеся заполняют анкету (Приложение 3).
Умение проводить оценку и самооценку.
Список использованной литературы :
Дмитриева В.Ф. Физика для профессий и специальностей технического профиля. Учебник. – М., 2014;
Дмитриева В.Ф. Физика для профессий и специальностей технического профиля. Сборник задач. – М., 2014;
Дмитриева В.Ф. Васильев Л.И. Физика для профессий и специальностей технического профиля. Контрольные материалы. – М.2016.
Методика преподавания физики в средней школе: Частные вопросы / Под ред. С. Е. Каменецкого, Л.А. Ивановой. – М.: Просвещение, 1987. – 336 с.
Методика преподавания физики в средней школе: Молекулярная физика. Электродинамика / Под ред. С. Я. Шамаша. – М.: Просвещение, 1987. – 256 с.
Смирнов А. В. Методика применения информационных технологий в обучении физике. – М.:Издательский центр «Академия», 2008. – 240 с.
Приложение 1
Идеальный газ. Температура.
Вариант 1
1. Давление газа на стенку сосуда обусловлено…
А. притяжением молекул друг к другу
Б. столкновениями молекул со стенками сосудов
В. столкновением молекул газа между собой
Г. проникновением молекул сквозь стенки сосуда
2. Как изменилось давление идеального газа, если в данном объеме скорость каждой молекулы газа увеличилась в 2 раза, а концентрация молекул осталась без изменения?
А. увеличилось в 2 раза
Б. увеличилось в 4 раза
В. уменьшилось в 2 раза
Г. уменьшилось в 4 раза
3. При повышении температуры идеального газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с ростом температуры...
А.увеличиваются размеры молекул газа
Б. увеличивается энергия движения молекул газа
В. увеличивается потенциальная энергия молекул газа
Г. увеличивается хаотичность движения молекул газа
4. Как изменится концентрация молекул газа при уменьшении объема сосуда в 2 раза?
А.увеличится в 2 раза
Б. уменьшится в 2 раза
В. не изменится
Г. уменьшится в 4 раза
5. При уменьшении температуры средняя кинетическая энергия молекул
А. увеличится
Б. уменьшится
В. не изменится
Г. иногда увеличится, иногда уменьшится
6. Если при неизменной температуре концентрация газа уменьшится в 3 раза, то давление:
в) уменьшится в 3 раза; г) увеличится в 3 раза.
7 . Во сколько раз изменится кинетическая энергия газа, если его температура уменьшится в 4 раза:
8.Сопоставьте выражение и формулу
В) 
9. Средняя кинетическая энергия молекул газа равна 2,25 ∙ 10 -20 Дж. При какой температуре находится газ?
а) 465 К; б) 1087 К; в) 1347 К; г) 974 К.
10. Найдите концентрацию молекул кислорода, если его давление 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/с.
Критерии оценки: «5» - 11 -12 баллов;
«4» - 9-10 баллов
«3» - 6-8 баллов
«2» - 0-5 баллов
Идеальный газ. Температура.
Средняя кинетическая энергия движения частиц
Вариант 2.
Задания 1-8 оцениваются в 1 балл, задания 9-10 - в 2 балла.
Максимальное количество баллов за работу – 12.
Газ, называется идеальным, если:
а) взаимодействие между его молекулами пренебрежимо мало;
б) кинетическая энергия молекул много меньше потенциальной энергии;
в) кинетическая энергия молекул много больше потенциальной энергии;
г) похож на разряженный газ.
2. Если среднюю квадратичную скорость молекул уменьшить в 3 раза (при n = соnst ), то давление идеального газа
А) увеличится в 9 раз Б) уменьшится в 3 раза
В) уменьшится в 9 раз Г) увеличится в 3 раза.
3.Давление газа будет тем больше, чем:
а) больше скорость движения молекул; б) больше молекул ударяется о стенку;
в) не зависит от скорости движения молекул; г) верны ответы а) и б).
4. При увеличении объема сосуда в 2 раза, концентрация молекул газа…
А.увеличится в 2 раза
Б. уменьшится в 2 раза
В. не изменится
Г. уменьшится в 4 раза
5. Средняя кинетическая энергия теплового движения молекул идеального газа при увеличении абсолютной температуры газа в 3 раза
А) увеличится в 3 раза. Б) уменьшится в 3 раза. В) уменьшится в 9 раз
Г) увеличится в 9 раз.
6. Если при неизменной температуре концентрация газа увеличится в 3 раза, то давление:
а) увеличится в 9 раз; б) не изменится
в) уменьшится в 3 раза; г)увеличится в 3 раза.
7 . Во сколько раз изменится кинетическая энергия газа, если его температура увеличится в 4 раза:
а) уменьшится в 16 раз; б) увеличится в 16 раз;
в) увеличится в 4 раза; г) уменьшится в 4 раза.
8. Поставьте в соответствие
Температура по шкале Цельсия (°С)Температура по шкале Кельвина (К)
1) 0
А) 273
2) 27
Б) 246
3) – 273.
В) 0
Г) 300
9. Какова концентрация молекул кислорода (молярная масса 32 г/ моль), если средняя квадратичная скорость их движения при давлении 0,2 МПа равна 300м/с
а) 0,3 ∙ 10 26 м 3 ; б) 1,3 ∙ 10 26 м 3 ; в) 13∙ 10 26 м 3 ; г) 2,6 ∙ 10. 26 м 3
10. В ампуле содержится водород (Н 2). Определите давление газа, если его концентрация равна 2· 10 25 м -3 , а средняя квадратичная скорость движения молекул водорода 500 м/с.
Критерии оценки: «5» - 11 -12 баллов;
«4» - 9-10 баллов
«3» - 6-8 баллов
«2» - 0-5 баллов
Ключи к тесту и критерии оценивания
Критерии оценки: «5» - 11 -12 баллов;«4» - 9-10 баллов
«3» - 6-8 баллов
«2» - 0-5 баллов
Приложение 2
Уравнение Менделеева-Клапейрона. Газовые законы
Вариант 1
Каждое задание оценивается в 1 балл.
1.
Выражение  является
является
А) законом Шарля, Б) законом Бойля-Мариотта,
В) уравнением Менделеева-Клапейрона, Г) законом Гей-Люссака.
2. При изохорном процессе в газе не изменяется (при т = = сonst ) его:
А) давление. Б) объём. В) температура.
3. Изобарный процесс в идеальном газе представлен графиком

4. Выражение  (
(
Приложение 3
Задание ученикам по рефлексии их деятельности.
Предлагается заполнить небольшую анкету:
1. На уроке я работал2. Своей работой на уроке я
3. Урок для меня показался
4. Материал урока мне был
5. Свою работу на уроке я оцениваю (оцените работу по 10-балльной шкале).
6. Домашнее задание мне кажется
активно / пассивно
доволен / не доволен
коротким / длинным
понятен / не понятен
полезен / бесполезен
интересен / скучен
1 2 3 4 5 6 7 8 9 10
легким / трудным
интересным / неинтересным